의료 국내 개발 코로나19 백신(1/2상) 2종 임상 승인
페이지 정보
작성자휴먼아카데미 댓글 0건 작성일 20-12-23 14:21본문
국내 개발 코로나19 백신(1/2상) 2종 임상 승인 코로나19 치료제·백신 국내 임상시험 총 25건 진행 중 |
□ 식품의약품 안전처는 국내 개발 코로나19 백신 'AdCLD-CoV19((주)셀리드)' 및 'GLS-5310(진원생명과학(주))'에 대한 임상시험을 12월 4일 각각 승인하였습니다.
○ 이로써 현재 국내에서 코로나19 관련하여 승인한 임상시험은 총 33건이며, 이 중 25건(치료제 20건, 백신 5건)이 임상시험 진행 중에 있습니다.
<<AdCLD-CoV19((주)셀리드>>
□ 이번 임상시험은 건강한 성인을 대상으로 해당 백신의 안전성 및 면역원성을 평가하기 위한 1/2상 임상시험입니다.
*면역원성 : 바이러스 감염성을 없애거나 낮추는 '중화항체' 증가 비율
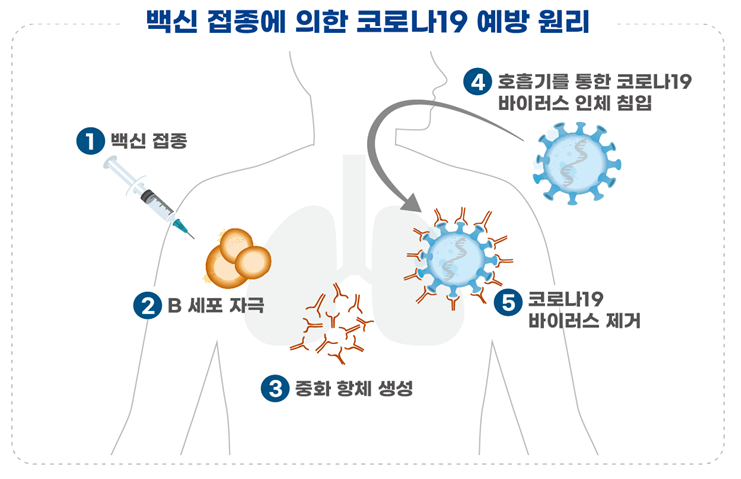
○ 해당 백신은 코로나19 바이러스의 '표면 항원 유전자'를 아데노 바이러스 주형에 넣어 제조한 '바이러스벡터 백신'입니다.
- 예방원리는 아데노 바이러스 주형을 통해 사람 세포 내로 전달된 표면항원 유전자가 체내에서 표면항원 단백질을 합성하여 중화항체 생성을 유도하고, 이후 코로나19 바이러스가 침입했을 때 이 중화항체가 코로나19 바이러스를 제거하게 됩니다.
○ 참고로, 국외에서도 바이러스벡터 플랫폼의 코로나19 백신에 대한 3상 임상시험이 진행되고 있습니다. (영국 아스트라제네카사, 중국 캔시노사, 러시아 가말레야 연구소, 미국 존슨앤드존슨 사)
<<GLS-5310 (진원생명과학(주))>>
□ 이번 임상시험은 건강한 성인을 대상으로 해당 백신의 안전성 및 면역원성을 평가하기 위한 1/2상 임상시험입니다.
○ 해당 백신은 코로나19 바이러스의 '표면 항원 유전자'를 DNA(플라스미드) 형태로 제조한 'DNA 백신'입니다.
- 예방원리는 접종한 코로나19 바이러스 표면항원 유전자에 의해 체내에서 표면항원 단백질을 합성하여 중화항체 생성을 유도하고, 이후 코로나19 바이러스가 침입했을때 이 중화항체가 코로나19 바이러스를 제거하게 됩니다.
○ 참고로, 국내 외에서 DNA 백신 플랫폼의 코로나19 백신에 대한 임상시험이 진행되고 있습니다.(국내 제넥신사 1/2상, 미국 이노비오사 2상)
※ 앞서 임상시험을 승인한 3건의 코로나19 백신은 코로나19 바이러스의 표면항원 유전자(DNA)를 주입하여 체내에서 표면항원 단백질을 생성함으로써 면역반응을 유도하는 DNA 백신이거나, 유전자 재조합 기술을 이용하여 제조한 코로나19 바이러스의 '표면항원 단백질'을 체내에 직접 주입하여 면역 반응을 유도하는 재조합백신임
□ 식약처는 앞으로도 코로나19 치료제, 백신 개발에 대한 국민적 관심이 높은 점 등을 고려하여 개발 제품의 임상시험 현황에 대한 정보를 신속하게 전달하겠습니다.
○ 또한, 안전하고 효과있는 코로나19 치료제, 백신이 신속히 개발될 수 있도록 필요한 사항을 지원하여 우리 국민이 치료 기회를 보장받을 수 있도록 최선을 다할 계획입니다.
<국내 코로나19 임상시험 승인 현황[2020. 12.4. 기준]>
♣ 치료제
1. 길리어드사이언스코리아 유한회사 (렘데시비르) : 중증 COVID-19 시험대상자에서 렘데시비르의 안전성 및 항 바이러스 활성을 평가하기 위한 제 3상 무작위 배정시험(종료), 3상(단계), 2020. 03. 02.(승인일)
2. 길리어드사이언스코리아 유한회사(렘데시비르) " 중등도 COVID-19 시험대상자에서 표준 치료 투여와 비교해 렘데시비르의 안전성 및 항 바이러스 활성을 평가하기 위한 제3상 무작위 배정시험(종료), 3상(단계), 2020. 03. 02.(승인일)
3. 서울대학교병원(렘데시비르) : COVID-19에 대한 remdesivir의 안전성과 유효성에 대한 다기관, 무작위배정, 이중눈가림, 위약대조연구(종료), 연구자 임상(단계), 2020. 03. 05.(승인일)
4. 재단법인아산사회복지재단서울아산병원(칼레트라정, 옥시크로린정) : 경증 코로나19 환자에서 lopinavir/ritonavir vs hydroxychloroquine vs 비투약군 간의 open labelled randomized controlled clinical trial [종료], 연구자임상(단계), 2020. 03. 20.(승인일)
5. 강남세브란스병원(할록신정) : SARS CoV -2 에 대한 노출 후 예방으로서 하이드록시 클로르퀸 연구(종료), 연구자 임상(단계), 2020.03.25.(승인일)
6. 고려대학교구로병원(알베스코 흡입제) : 경증 코로나19 환자에서 Ciclesonide 의 임상적 유효성 평가, 연구자임상(단계), 2020.03.27.(승인일)
7. 부광약품(주) 레보비르 캡슐30mg(클레부딘) : 중등증 코로나바이러스 감염증 -19 환자에서 클레부딘의 안전성과 유효성을 평가하는 단일맹검, 무작위배정, 위약대조, 다기관 제 2상 임상시험, 2상(단계), 2020. 04.14.(승인일)
8. 경상대학교병원 (후탄(나파모스타트)): 코로나19 폐렴 환자에서 Nafamostat mesilate의 치료효과 분석을 위한 공개, 무작위 배정, 대조 임상시험, 연구자임상(단계), 2020.04. 17.(승인일)
9. 동아대학교병원(페로딜 정), COVID-19 감염 중증 폐렴 환자의 폐 기능에 관한 이펜프로디리의 28일 제 2a상 공개, 연구자 주도 연구(종료), 연구자임상(단계), 2020.04.21(승인일)
10. 엔지켐 생명과학(EC-18) : 신종 코로나바이러스로 인한 폐렴 환자에서 EC-18의 안전성과 유효성을 평가하기 위한 다기관, 무작위 배정, 이중 눈가림 제 2상 임상시험, 2상(단계), 2020.05.12.(승인일)
11. 신풍제약(주)(피라맥스정) : 경증 또는 중등증 코로나바이러스감염증-19 환자를 대상으로 피라맥스 정의 유효성 및 안전성을 비교, 평가하기 위한 다기관, 무작위배정, 이중 눈가림, 평행, 위약대조, 제 2상 임상시험, 2상(단계), 2020.05.13.(승인일)
12. 서울대학교병원(바르시티닙) : 코로나19에 대한 새로운 약제들의 안전성과 유효성에 대한 다기관, 무작위 배정, 이중눈가림, 위약대조연구(종료), 연구자임상(단계), 2020. 05.18.(승인일)
13. (주)종근당 (CKD-314(나파모스타트)) : 코로나19 폐렴으로 진단받아 입원한 환자 대상으로 CKD-314의 유효성과 안전성을 평가하기 위한 공개, 다기관, 무작위배정, 치료적 탐색 제 2상 임상시험, 2상(단계), 2020. 06. 17.(승인일)
14. 크리스탈지노믹스(주) (CG-CAM20(키모스타트)) : 코로나19 바이러스 감염이 확진된 코로나19 환자에서의 카모스타트 치료의 유효성 및 안전성을 평가하기 위한 무작위 배정, 이중 눈가림, 위약대조, 평행 2상 임상 시험, 2상(단계), 2020. 07. 01.(승인일)
15. (주) 대웅제약 (DW1248정(카모스타트)) : 경증 및 중등증 코로나19 환자를 대상으로 DW1248의 유효성 및 안전성을 평가하기 위한 이중 눈가림, 무작위 배정, 위약대조, 다기관 제 2상 임상시험, 2상(단계), 2020. 07. 06.(승인일)
16. (주) 셀트리온(CT-P59) : 건강한 시험대상자를 대상으로 CT-P59의 안전성, 내약성 및 약동학을 평가하는 제1상, 무작위배정, 이중눈가림, 위약대조군, 평행군, 단회 투여 용량 증량 임상시험(종료), 1상(단계), 2020. 07.17(승인일)
17. 서울대학교병원(Rebif(인터페론)) : 코로나19에 대한 새로운 약제들의 안전성과 유효성에 대한 다기관, 무작위배정, 이중눈가림, 위약대조연구, 연구자임상(단계), 2020.08. 04.(승인일)
18. (주)제넥신 (GX-I7(인터루킨)): 코로나바이러스 감염된 환자에서 GX-I7의 안전성 및 예비효과 탐색을 위한 제 1b 상 임상시험, 1b상(단계), 2020. 08.07.(승인일)
19. (주) 녹십자(GC5131(혈장분획치료제) :코로나19 환자에서 H-I9(고면역글로불린) GC5131의 용량 설정 및 유효성, 안전성을 평가하기 위한 전향적, 공개, 무작위배정, 다기관 제 2상 임상시험, 2상(단계), 2020. 08. 20.(승인일)
20. (주)셀트리온(CT-P59) : 코로나19 바이러스 감염 경증 증상이 있는 시험대상자에서 CT-P59의 안전성, 내약성 및 바이러스학을 평가하는 제1상, 무작위 배정, 이중 눈가림, 위약대조, 평행군, 단일용량사승 투여 예비 연구, 1상(단계), 2020. 08. 25.(승인일)
21. 한국릴리(바리시티닙(LY3009104)) : 코로나19 감염 환자에 대한 바리시티닙의 무작위 배정, 이중 눈가림, 위약대조, 평행군, 제 3상 시험, 3상(단계), 2020. 09. 07.(승인일)
22. (주)셀트리온( CT-P59) : 경증 또는 중등증 코로나19 바이러스 감염 환자를 대상으로 표준치료와 병행하여 CT-P59의 유효성 및 안전성을 평가하는 2/3상 무작위 배정, 평행군, 위약대조, 이중 눈가림 임상시험, 2/3상(단계), 2020. 09. 17.(승인일)
23. (주)셀트리온(CT-P59) : 코로나19 바이러스 감염 환자와 접촉한 시험 대상자에서 CT-P59의 예방적 유효성, 바이러스학 및 안전성을 평가하는 제 3상, 무작위 배정, 평행군, 위약 대조, 이중 눈가림 임상시험, 3상(단계), 2020. 10.08(승인일)
24. (주)대웅제약(DWRX2003) : 건강한 성인을 대상으로 DWRX2003을 투여 후 안전성, 내약성 및 약동학적 특성을 평가하기 위한 무작위배정, 이중눈가림, 위약대조, 단회 투여, 1상 임상시험, 1상(단계), 2020. 10. 08. (승인일)
25. 한국엠에스디(MK-4482): 코로나19에 감염된 성인 입원 환자를 대상으로 MK-4482의 유효성과 안전성, 약동학을 평가하기 위한 제2/3상, 무작위배정, 위약대조, 이중 눈가림 임상시험, 2/3상(단계), 2020. 10. 29.(승인일)
26. 뉴젠테라피틱스(뉴젠 나파모스타트정(나파모스타트 메실산염)) : 건강한 성인 남성을 대상으로 뉴젠나파모스타트 정 경구투여 후 안전성, 내약성 및 약동학적 특성을 평가하기 위한 공개, 단회 투여 및 단계적 증량 반복 투여 임상 1상 시험, 1상(단계), 2020. 11. 03.(승인일)
27. 동화약품(주)(DW2008S) : 중등증 코로나 바이러스감염증-19 환자를 대상으로 DW2008S의 유효성 및 안전성을 비교 평가하기 위한 다기관, 무작위배정, 이중눈가림, 평행, 위약대조, 제2상 임상시험, 2상(단계), 2020. 11. 23.(승인일)
28. 서울대학교병원(렘데시비르, 바리시티닙, 덱사메티손) : 코로나19에 대한 remdesivir의 안전성과 유효성에 대한 다기관, 무작위배정, 이중 눈가림, 위약대조 연구, 연구자임상(단계), 2020. 12.03.(승인일)
♣ 백신
1. 국제백신연구소 : INO-4800 : 건강한 성인을 대상으로 피내 접종후 전기천공법을 이용하는 SARS-CoV-2 예방백신 INO-4800의 안전성, 내약성 및 면역원성을 평가하기 위한 용량 증량, 제 1/2a 임상시험, 1/2a 상, 2020. 06. 02.
2. (주)제넥신: GX-19 : 건강한 성인을 대상으로 코로나19 예방 DNA 백신 GX-19의 안전성, 내약성 및 면역원성을 탐색하기 위한 다기관, 무작위 배정, 이중 눈가림, 위약대조, 제 1/2a상 임상시험, 1/2a상, 2020. 06. 11.
3. 에스케이바이오사이언스(주) : NBP2001 : 건강한 만 19 ~ 55세 성인을 대상으로 SARS -CoV-2 백신(NBP2001)의 안전성, 내약성 및 면역원성을 평가하기 위한 용량 증가, 관찰자 눈가림, 위약 대조 1상 임상시험, 1상, 2020. 11. 23.
4. (주)셀리드 : AdCLD-CoV19 : 건강한 성인 자원자를 대상으로 코로나19 예방백신AdCLD-CoV19의 안전성, 면역원성을 확인하기 위한 1/2a상 (단계적 용량 증량, 단일기관, 공개 제1상 및 다기관, 무작위배정, 공개, 제2a상)임상시험, 1/2a상, 2020. 12. 04.
5. 진원생명과학(주): GLS-5310 : 코로나바이러스 감염증-19를 예방하기 위하여 건강한 성인에게 피내 접종하는 GLS-5310 DNA 백신의 안전성, 내약성 및 면역원성을 평가하는 용량증량(제1상), 다기관, 무작위배정, 이중눈가림, 위약대조 제2a상 임상시험, 1/2a상, 2020. 12. 04.
출처: 식약처
사진출처: 식약처
댓글목록
등록된 댓글이 없습니다.